Asitler ve Bazlar

Pow
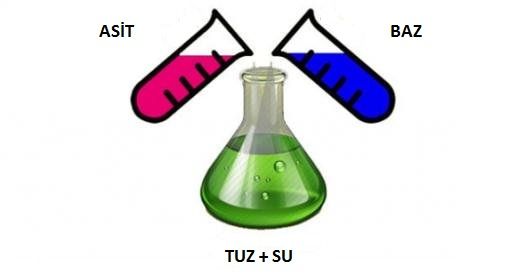
Asit ile Bazın Birleşmesi Sonucu Tuz ve Su Oluşur 1. Asitler Asitler, hemen hemen bütün kimyasal maddelerin yapısında bulunabilen hem en yararlı hem de en te
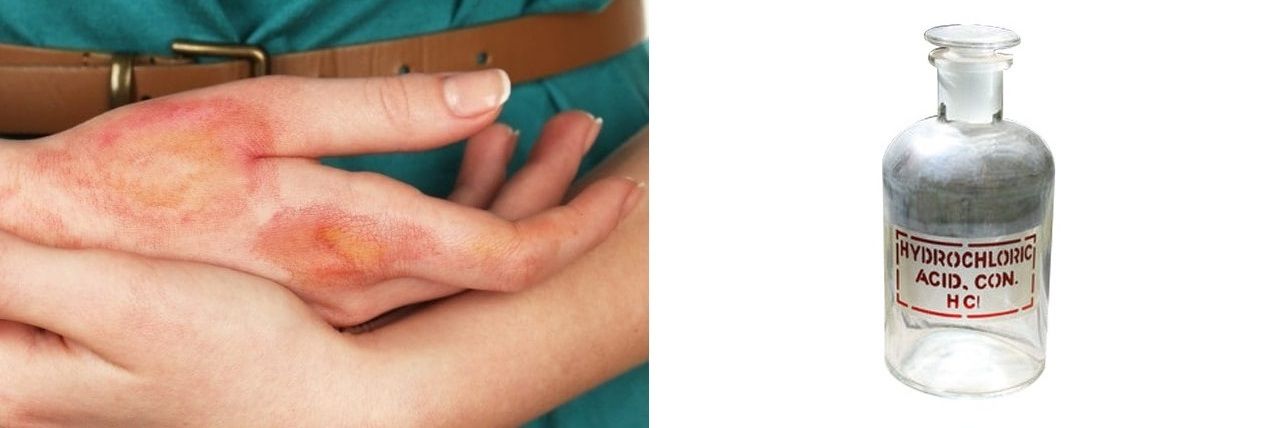
Asitler, hemen hemen bütün kimyasal maddelerin yapısında bulunabilen hem en yararlı hem de en tehlikeli bileşiklerdendir. Asit terimi Latince de “ekşi” anlamına gelen acidus sözcüğünden türetilmiştir. Gerçekten te bu bileşiklerin çoğunun tadı ekşidir. Örneğin sitrik asit (limon), asetik asit (sirke), hidroklorik asit (tuz ruhu), nitrik asit (kezzap) ve sülfürik asit (akü asidi) en bilinenleridir.
Asitlerin Genel Özellikleri
Tatları ekşidir (limon, sirke)
Mavi turnusol kâğıdının rengini kırmızıya dönüştürürler
Yakıcı ve aşındırıcı etkileri vardır
Suda çözündüklerinde genel olarak ortama (H+) iyonu verirler
Asit çözeltilerinin pH değeri 7’den küçüktür
Sulu çözeltileri elektrik akımını iletir
Üzerlerine fenolftalein çözeltisi (müshil ilacı) damlatıldığında renk değiştirmezler
Asit çözeltileri metil oranjın (metil turuncusu) rengini turuncudan kırmızıya dönüştürürler
Bazlarla nötrleşme adı verilen bir tepkimeye girerek tepkime sonunda tuz ve su oluşmasını sağlarlar
Genel olarak yapılarında bir hidroksil iyonu (OH-) ile en az bir metal iyonu bulunduran bileşiklere baz denir. Bazlar asitlerle birleşerek nötrleşme adı verilen bir tepkimeye girdiklerinde reaksiyon sonunda artık ne asit ne de baz özelliği gösterern ve tuz adı verilen nötr bir bileşik oluşur. Bazlara örnek olarak çeşitli sabun türleri, sodyum hidroksit (kostik, sudkostik), amonyak, sodyum bikarbonat (yemek sodası) ve kalsiyum karbonat(kireç taşı) örnek olarak verilebilir.
Bazların Genel Özellikleri
Tatları acıdır (sabun, kül, tatlı su)
Kırmızı turnusol kâğıdının rengini maviye dönüştürürler
Ele kayganlık hissi verirler
Suda çözündüklerinde genel olarak ortama (OH-) iyonu verirler
Baz çözeltilerinin pH değeri 7’den büyüktür
Sulu çözeltileri elektrik akımını iletir
Asitlerle nötrleşme adı verilen bir tepkimeye girerek tepkime sonunda tuz ve su oluşmasını sağlarlar
1. Antoine Laurent Lavoisier 'e Göre Asit
Fransız Kimyager Antoine Laurent Lavoisier, bütün asit bileşimlerinde olduğunu varsaydığı gaza Yunanca “asit yapıcı” anlamına gelen oksijen ismini vermişti. Ama bugün hepimiz bu tanımın doğru olmadığını biliyoruz. Örneğin HCl (Hidroklorik) asidin bileşiminde tek bir oksijen atomu bile yoktur.
2. Svante Arrhenius Asit-Baz Tanımı
Arrhenius’a göre; asitler, suda çözündüklerinde ortama hidrojen iyonu (H+) verebilen bileşikler iken bazlar ise, suda çözündüklerinde ortama hidroksil (OH-) iyonu verebilen bileşiklerdir. Arrhenius, sulu çözeltilerinde tamamen (%100) iyonlarına ayrışabilen asitleri ve bazları kuvvetli asit ve baz olarak tanımlarken, sulu çözeltilerinde kısmen iyonlarına ayrışabilen asitleri ve bazları ise zayıf asit ve baz olarak kabul etmiştir.
Ancak, Arrhenius’un asit-baz tanımının kendi içerisinde bazı çelişkili yanları bulunmakta olup örneğin zayıf bir baz olan ve 1 azot (N) ve 3 hidrojen (H) atomundan oluşan amonyağın bazlığını açıklayamamaktadır.
Brönsted-Lowry Asit-Baz Tanımı
1923 yılında birbirlerinden bağımsız olarak Danimarkalı bilim adamı Brönsted ve İngiliz bilim adamı Lowry, asidleri proton veren (H+ iyonu) ve bazları ise proton alan (H+ iyonu) bileşikler olarak tanımladı.
Brönsted-Lowry Asit-Baz Kuramına göre tipik bir asit-baz tepkimesinde asit kendisinin eşlenik bazına (konjuge baz), baz da kendisinin eşlenik asidine (konjuge asit) dönüşür.
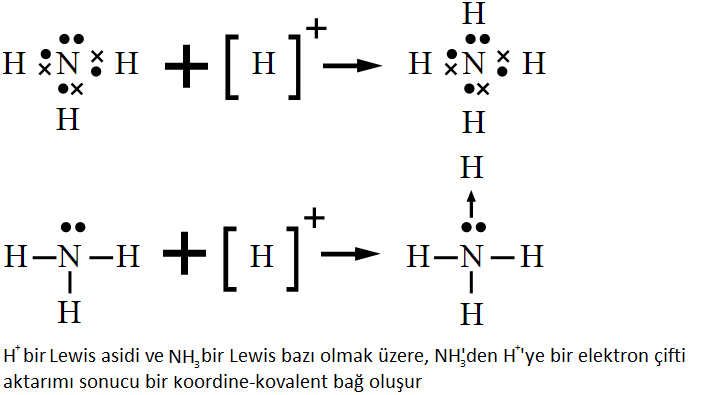
Lewis Asit-Baz Tanımı
1923’te Lewis, asidleri bir elektron çifti alıcısı, bazları ise bir elektron çifti vericisi olarak tanımladı.
Share Your Expertise, Earn Rewards!
Found this insightful? Imagine your knowledge generating income. Contribute your articles to bylge.com and connect with readers while unlocking your earning potential.