Atom Modelleri

Pow
Güçlü bir elektron mikroskobu altında çekilmiş gerçek bir atomun görüntüsü. Atom Nedir? Maddeleri oluşturan elementlerin tüm fiziksel ve kimyasal özellikleri
Atom Nedir?
Maddeleri oluşturan elementlerin tüm fiziksel ve kimyasal özelliklerini taşıyan en küçük yapı taşına atom denir. Atomların boyutları ve kütleleri o kadar küçüktür ki bir atomu çıplak gözle görmemiz ve terazi ile kütlesini ölçmemiz mümkün değildir.
Milattan önce 460-370 tarihleri arasında yaşamış olan Yunanlı ünlü düşünür Demokritos, bütün maddelerin çıplak gözle görülmesi mümkün olmayan ve bölünemeyen çok küçük parçacıklardan oluştuğunu öne sürerek bunlara Yunanca "bölünemez" anlamına gelen a-tomos ismini vermiştir. Günümüzdeki atom teriminin kaynağı da bu kelimedir.
Atom Modelleri
1. Dalton Atom Modeli
Demokritos’un fikirleri yaşadığı çağ da pek fazla ilgi görmediği için atom konusundaki bilgilerimiz de önemli bir gelişme olmaksızın 2000 yıldan fazla bir süre geçti. Atomun yapısını açıklamaya ve bu konuda bir model geliştirmeye çalışan ilk kişi İngiliz kimyager ve fizikçi John Dalton'dur (1766–1844). Günümüz de onun adı ile de anılan bu model üç temel ilkeye dayanıyordu.
1. Bütün maddeler atom denilen ve son derece küçük taneciklerden oluşmaktaydı. Atomlar ne vardan yok ne de yoktan var edilebilirlerdi ve bölünemezlerdi.
2. Aynı elementin atomları birbirinin aynıydı. Farklı elementlerin atomları ise birbirlerinden farklıydı.
3. Farklı elementlerin atomları basit tam sayılar ile ifade edilebileceğimiz oranlarda bir araya gelerek bileşikleri oluşturmaktaydı. Örneğin 2 hidrojen (H) atomu ile 1 oksijen (O) atomu bir araya gelerek su molekülünü oluşturuyorlardı.
2. Thomson Atom Modeli (Elektronun Keşfi)
1897 Yılında İngiliz bilim insanı Joseph John Thomson (1856-1940) Katot Işın Tüpünü (Crooks Tüpü) kullanarak elektronları keşfetti. Katot ışın tüpleri genellikle içerisinde bulunan havanın büyük oranda boşaltıldığı vakumlu tüplerdir. Tüpün bir ucunda anot (+) ile katot (-) adını verdiğimiz ve birbirlerine belirli bir mesafede duran iki elektrot bulunur. Thomson, elektrotların arasına yüksek bir voltaj (gerilim) uyguladığında katot kutbundan anot kutbuna doğru akan yeşilimsi bir ışın demetinin meydana geldiğini fark etti. "Katot Işınları" olarak ta bilinen bu gizemli ışın demetleri, elektronların hareketinden başka bir şey değildi ve böylelikle elektronların varlığı keşfedilmiş oldu. Elektronların keşfi ile birlikte Dalton’un öne sürdüğü ve atomun bölünemez olduğu yönündeki kuramın da yanlış olduğu ortaya çıktı.
Bir atomun en dış kısmındaki yörüngesindeki elektronlar kolayca atomdan ayrılarak serbest bir şekilde hareket edebilirler. Örneğin bir cam çubuğu ipekli bir kumaşa sürttüğümüzde cam çubuğu oluşturan atomların en dış kısmındaki yörüngesindeki elektronlar kolayca cam çubuktan ayrılarak onun artı elektrik yükü ile yüklenmesini sağlarlar. Artı elektrik yükü ile yüklenmiş durumdaki cam çubuğu ufak kâğıt parçacıklarına doğru yaklaştırdığımızda kâğıt parçacıklarını oluşturan atomların en dış kısmındaki yörüngesindeki elektronlar kolayca kâğıt parçacıklarından ayrılarak cam çubuğa doğru hareket etmeye başlarlar. Böylelikle artı elektrik yükü ile yüklü hale gelen kâğıt parçacıkları ve eksi elektrik yüklü durumdaki cam çubuk zıt elektrik yüküne sahip oldukları ve cam çubuk kâğıt parçacıklarına göre daha ağır olduğu için kâğıt parçacıkları cam çubuğa doğru yaklaşır ve yapışırlar.
Thomson’ın öne sürdüğü atom modeline göre atom üzümlü bir keke benzetilmiş ve aşağıdaki gibi olduğu varsayılmıştır.
1. Atomlar artı yüklü bir maddeden oluşmaktadırlar ve elektronlar ise adeta bir kekin içerisine dağılmış üzüm taneleri gibi ve hareketsiz bir şekilde bu artı yüklü maddenin içerisinde gömülü bir şekilde durmaktadırlar.
2. Bir elektronun kütlesi atomun kütlesinin yanında ihmal edilecek kadar küçüktür (1/2000) ve ayrıca atomun kütlesinin büyük bir kısmını artı yüklü madde oluşturmaktadır.
3. Atomlar küreyi andıran bir şekle sahiptirler.
3. Rutherford Atom Modeli (Çekirdeğin Keşfi)
Yeni Zellandalı bilim insanı Ernest Rutherford (1871-1937) radyoaktif elementlerin çekirdeklerinden yayılan ve onların parçalanarak başka elementlere dönüşmesini sağlayan ışınlardan biri olan +2 yüklü alfa (α) taneciklerini kullanarak bir takım deneyler yaptı. Rutherford, deneylerinin birinde yüksek hıza sahip α taneciklerinin ince altın bir levhayı bombardıman etmesine izin verdi. Ancak deneyin sonunda hiç beklemediği bir sonuçla karşılaştı.
Thomson Atom Modeli’ne göre artı yükler atomun tamamına yayılmış bir durumda bulunmaktaydılar ve yüksek hıza sahip artı yüklü α taneciklerinin büyük bir kısmı hiçbir engelle karşılaşmadan ve kolaylıkla bu artı yük havuzunun (suyun altındaki bir denizaltıdan fırlatılan bir torpidonun hedefine doğru hareket etmesi gibi) içinden geçebilirlerdi. Ancak deneyin sonunda alfa taneciklerinin çok büyük bir kısmı herhangi bir engelle karşılaşmadan ve kolay bir şekilde karşı tarafa geçerken az bir kısmı sapma gösterdi ve çok az bir kısmı da geri sıçradı. Rutherford deneyinin sonunda aşağıdaki sonuçlara vararak Thomson’ın öne sürdüğü Atom Modeli’nin birçok yanlışlar içerdiğini ve doğru olmadığını ileri sürdü.
Rutherford pozitif yüklü α taneciklerinin büyük bir kısmının herhangi bir engelle karşılaşmadan atomun içinden geçit gitmesini atomun hacminin büyük bir bölümünün boşluklardan oluştuğu için olabileceğini öne sürdü.
Pozitif yüklü alfa taneciklerinin çok küçük bir kısmı geri sıçrayıp çıktıkları yere dönüyorlarsa o zaman atomun artı yüklü kısmı Thomson'un öne sürdüğünün tersine atomun içinde çok küçük bir yer kaplamalıydı.
Bütün bu sonuçlara dayanarak Rutherford kendi modeli olan Çekirdek Atom Modeli’ni öne sürdü. Bu modele göre atomun büyük bir kısmı boşluktan ibaretti. Artı yüklü olan ve atom kütlesinin büyük bir kısmını oluşturan çekirdek çok küçük bir yer kaplayacak şekilde atomun merkezinde bulunuyordu. Eksi yüklü elektronlar ise atomun hacmini oluşturacak şekilde çekirdeğin çevresinde dolanmaktaydılar. Ayrıca çekirdeğin artı yükü elektronların eksi yükünü dengelediği için bir atom dışarıdan bakıldığında nötr (yüksüz) bir durumda görünmekteydi.
Çekirdek ve İçerisindeki Muazzam Enerji
Bugün artık biliyoruz ki bir atomun çekirdeğinde artı elektrik yüküne sahip protonlardan başka herhangi bir elektrik yükü taşımayan ve nötron denilen tanecikler de bulunur. Doğadaki elementlerin birbirlerinden farklı olmalarının nedeni atomlarındaki proton sayılarının farklı olmasıdır. Örneğin bir karbon atomunun çekirdeğinde 6 proton bulunurken bir demir atomunun çekirdeğinde 26 proton bulunur. Doğada aynı elektrik yüküne sahip olan cisimler birbirlerini iterler. Peki, bir atomun çekirdeğinde bulunan ve aynı elektrik yüküne sahip protonlar nasıl oluyor da bir arada duruyorlar. Bunun sebebi çekirdekteki güçlü nükleer kuvvettir ve bu kuvvetin değeri çok büyüktür. Eğer bir atomun çekirdeğine yüksek bir hıza ulaştırılmış bir proton veya nötron gönderirsek çekirdeğin içerisine giren bu protonlar veya nötronlar onun dengesini bozarak en az iki parçaya ayrılmasını sağlarlar. Bu sırada, çekirdekteki protonları bir arada tutan güçlü nükleer kuvvet serbest kalır ve bir miktar kütle de enerjiye dönüşerek muazzam büyüklükte bir enerjinin ortaya çıkması sağlanmış olur. Kütlenin enerjiye dönüşümü sırasında ne kadar bir enerjinin elde edilebileceği Albert Einstein’ın ünlü denklemi E = m.c² ile kolaylıkla hesaplanabilir. Örneğin atom bombası bu ilkelere dayanarak üretilmektedir.
4. Bohr Atom Modeli ve Enerji Düzeyleri
Rutherford atomu bir güneş sistemine benzeterek merkezine de çekirdeği yerleştirmişti ama elektronların hareketini tam olarak açıklayamadı. Çekirdeğin çevresinde dönmekte olan elektronların bir süre sonra enerjisinin tükenerek ve çekirdeğin çekim gücünün de etkisi ile çekirdeğin içine düşüp çökmeleri gerekiyordu ancak neden böyle bir durum gerçekleşmiyordu.
Danimarkalı Fizikçi Niels Bohr 1911 yılında yayımladığı bir makale de elektronların hareketi ile ilgili çok önemli açıklamalarda bulundu.
Bohr’a göre;
1. Elektronlar çekirdekten belirli bir uzaklıkta bulunan yörüngelerde dairesel şekilde hareket etmekteydiler.
2. Çekirdeğe en yakın durumdaki elektronlar en kararlı olanlar iken çekirdekten en uzak durumdaki elektronlar en kararsız olanlardı.
3. Elektronların kararlı şekilde bulundukları enerji düzeyleri 1, 2, 3, … , n gibi basit tam sayılar ile ifade edilebilirdi.
4. Bir elektrona dışarıdan bir enerji verildiği zaman o elektron bir üst enerji seviyesine geçerek kararsız bir hale gelmekte ve tekrar eski yerine geri dönmek istemekteydi. Kısa bir süre sonra tekrar eski yerine geri dönen bu elektron almış olduğu fazla enerjiyi ısı, ışık veya başka bir enerji türü şeklinde bulunduğu ortama yaymaktaydı. Örneğin ısıtılan demirin bir süre sonra kızarması veya güneş altında kalan bir cismin zamanla sıcaklığının artması bu duruma örnek olarak verilebilir.
Bileşiklerin Oluşumu
İki veya daha fazla elementin atomları bir araya gelerek yeni bir bileşik oluştururken bu elementlerin atomlarının en dış yörüngesinde bulunan ve en kararsız durumdaki elektronlar önemli rol bir oynarlar. Oynak elektronlar dediğimiz bu elektronlar bir atomdan diğerine geçerek bu iki atomdan tamamen farklı fiziksel ve kimyasal özellikler taşıyan yeni bir molekülün (bileşik) oluşmasını sağlarlar.
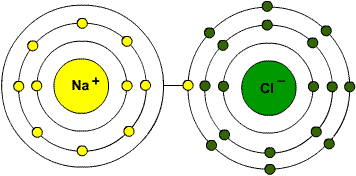
Örneğin nötr durumda 11 elektronu bulunan sodyum atomunun 1. yörüngesinde 2 2. yörüngesinde 8 ve 3. yörüngesinde 1 elektron bulunurken nötr durumda 17 elektronu bulunan klor atomunun ise 1. yörüngesinde 2 2. yörüngesinde 8 ve 3. yörüngesinde 7 elektron bulunur. Bu iki elementin atomları bir araya geldiklerinde sodyum atomları son yörüngelerinde bulunan ve en kararsız durumdaki bir elektronlarını yitirerek kimyasal olarak daha kararlı olan sodyum iyonlarına (Na+) dönüşürler. Klor atomları ise sodyum atomlarının yitirdiği bu bir elektronu kaparak son yörüngelerindeki elektron sayısını sekize çıkararak daha kararlı olan klor iyonlarına (Cl-) dönüşürler. Artı yüklü sodyum iyonları ile eksi yüklü klor iyonları zıt elektrik yükü ile yüklü olduklarından sonunda birbirlerini çekerek birleşirler ve Sodyum Klorür (Yemek Tuzu) adı verilen yeni bir bileşiğin oluşmasını sağlarlar.
5. Modern Atom Teorisi
Bugünkü bilgilerimiz ve Modern Atom Teorisi’nin bize söylediğine göre;
1. Elektronları Bohr’un öne sürdüğünün aksine belirli yörüngelerde sabit hızlarla dönen tanecikler olarak düşünmek doğru değildir. Elektronlar hem kendi etraflarında hem de çekirdeğin etrafında dönerler.
2. Modern Atom Teorisi orbital kavramını getirerek elektronların çekirdeğin etrafındaki yörüngelerde (enerji düzeyi) bulunma olasılığının en fazla olduğu yerlerden bahsetmektedir.
3. Elektronlar çekirdeğin çevresindeki belirli enerji seviyelerinde bulunurlar ve her enerji seviyesi “n” ile gösterilir. Bu enerji seviyelerine baş kuantum sayısı denir ve bu baş kuantum sayıları orbitallerin çekirdekten olan ortalama uzaklığını ya da enerjisini ifade ederler. Elektronların çekirdekten uzaklaştıkça enerjileri artarken çekirdeğe yaklaştıkça enerjileri azalır. Çünkü çekirdekten uzaklaştıkça protonların elektronları çekme gücü azalır ve buna bağlı olarak da elektronların hareket serbestliği ve enerjisi artar.
4. Herhangi bir temel enerji seviyesinde n² kadar orbital bulunabilirken orbital sayısının 2 katı kadar (2n²) elektron bulunabilir.
Bugün artık biliyoruz ki Demokritos’un ve başka birçok bilim insanının iddia ettiğinin aksine atom artık bölünebilmekte ve atom altı parçacıklar dediğimiz proton, nötron ve elektron gibi temel taneciklerin de kendilerinden daha küçük ve kuark adını verdiğimiz parçacıklardan oluştuğu bilinmektedir.
Share Your Expertise, Earn Rewards!
Found this insightful? Imagine your knowledge generating income. Contribute your articles to bylge.com and connect with readers while unlocking your earning potential.