Avogadro Yasası ve Avogadro Sayısı

Pow
1. Avogadro Yasası İtalyan kimyacı Amedeo Avogadro, bugün kendi adıyla anılan Avogadro Yasası'nı ortaya koymuştu. 1811 Yılında İtalyan kimyacı Amedeo Avogadro
1. Avogadro Yasası
1811 Yılında İtalyan kimyacı Amedeo Avogadro, aynı koşullar altında (basınç ve sıcaklık) bulunan bütün gazların eşit hacimlerinde eşit sayıda tanecik (molekül) bulunduğunu öne sürdü. Bugün onun adıyla anılan bu yasaya Avogadro Yasası denir.
Fransız Kimyacı Joseph Louis Gay-Lussac daha önce gazlarla ilgili yaptığı bir deneyde aynı basınç ve sıcaklıkta olmak üzere 1 hacim azot (N) ve 1 hacim oksijen (O) gazından 2 hacim azot monoksit (NO) gazının oluştuğunu tespit etmişti. O zamanki kimya bilgilerine göre bu durum gerçekten çok şaşırtıcı bir şeydi ve Dalton’un Atom Kuramı ile de çelişiyordu. Çünkü Dalton’a göre atomlar bölünemezdi ve 1 birim azot ile 1 birim oksijen elementi tepkimeye girdiğinde 1 birim azot monoksit bileşiğinin oluşması gerekiyordu.
Uzun yıllar gazlar üzerinde incelemeler yapan ve davranışlarını açıklamaya çalışan Avogadro, gaz halindeki elementlerin genellikle tek başlarına bulunmadıklarını (soy gazlar hariç) molekül adı verilen ve ikişer ikişer bağlanmış atom çiftleri şeklinde bulunduklarını söyleyerek yukarıdaki çelişkili duruma bir açıklama getirdi.
Avogadro, yukarıdaki durumun doğru olabilmesi için aynı sıcaklık ve basınç altındaki gazların eşit hacimlerinde eşit sayıda tanecik (molekül) olması gerektiğini ve ayrıca reaksiyona giren gazların tek bir atom taneciği şeklinde değil de ikişer ikişer atomlu moleküller şeklinde olmaları gerektiğini söyledi. Yukarıdaki tepkimeye dönersek 2 hacim hidrojen gazı 2n tane molekülden oluşurken 1 hacim oksijen gazı n tane molekülden oluşmaktadır ve reaksiyon sonunda oluşan 2 hacim su buharı ise 2n tane molekülden oluşur.
Yukarıda anlattığımız şeyleri kısaca özetlersek, bir gazın sıcaklığını ve basıncı sabit tutarak tanecik sayısını arttırırsak hacmini de arttırmış oluruz. Örneğin n tane tanecikten oluşan bir gazın hacmi v birim ise gazımızın tanecik sayısını 2 katına çıkarıp 2n yaparsak hacmi de 2 katına çıkar ve 2v birim olur.
2. Avogadro Sayısı
Avogadro Sayısı veya Avogadro Sabiti, bir elementin bir molündeki atom sayısına ya da bir bileşiğin bir molündeki molekül sayısına denir. 1 mol yani 12 gr C-12 izotopundaki atom sayısı deneysel olarak hesaplanmış ve yaklaşık olarak 6.02214199x10²³ bulunmuştur. Avogadro sayını, Amedeo Avogadro’nun kendisi bulmamıştır ancak bu alanda yaptığı çalışmalardan dolayı onuruna bu sayıya onun ismi verilmiştir.
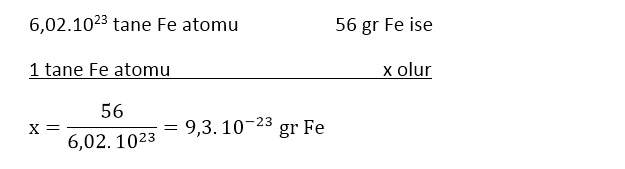
Örneğin demir (Fe) atomun izotoplarından biri olan Fe-56’nın proton sayısı 26 ve nötron sayısı 30 olup kütle numarası (proton + nötron sayısı) 56’ya eşittir. O zaman;
1 mol Fe atomu = 56 gr Fe = 6.02x10²³ tane Fe atomu’dur.
Yukarıdaki eşitlikten yola çıkarak 1 tane Fe atomun kütlesini bulalım .
Bulduğumuz değer 1 tane demir atomunun kütlesi olup 93 sayısının sol tarafına 22 tane sıfır (0,000 000 000 000 000 000 000 093 gr) konularak elde edilen çok çok küçük ve terazi ile ölçülmesi mümkün olmayan bir büyüklüktür.
Share Your Expertise, Earn Rewards!
Found this insightful? Imagine your knowledge generating income. Contribute your articles to bylge.com and connect with readers while unlocking your earning potential.