bileşik nedir

Pow
bileşik İki veya daha fazla türde farklı elementin, kimyasal özelliklerini kaybedecek şekilde ve basit tam sayılarla ifade edebilecek oranlarda bir araya gelme
bileşik
İki veya daha fazla türde farklı elementin, kimyasal özelliklerini kaybedecek şekilde ve basit tam sayılarla ifade edebilecek oranlarda bir araya gelmeleri sonucunda oluşan saf ve homojen maddelere bileşik denir.
Örneğin hidrojen (H) yanıcı bir özelliğe sahip iken, oksijen (O) ise yakıcı bir özelliğe sahiptir. Kapalı bir kabı hidrojen (H2) ve oksijen (O2) gazı ile doldurur ve bir kıvılcım ile tutuşturursak ufak bir patlamadan sonra meydana gelen kimyasal reaksiyon sonucunda ne yanıcı ne de yakıcı bir özelliği olan ve su olarak bildiğimiz aksine yangın söndürücü olarak da kullanılan H2O şeklinde bir bileşik meydana gelir.
H2 (yanıcı) + O2 (yakıcı) → H2O (yangın söndürücü)
bileşik örnekleri
NaCl (yemek tuzu), NaOH (kostik), CO (karbonmonoksit), CO2 (karbondioksit), C2H5OH (alkol), SO2 (kükürt dioksit), HNO3 (kezzap), C12H22O11 (çay şekeri), CH4 (metan gazı), C6H6 (benzen), CaO (kireç) kimyasal bileşiklere örnek olarak verilebilir.
bileşiklerin özellikleri
bileşik çeşitleri (bileşik türleri)
Kimyasal bileşikler, iyonik bileşikler ve moleküler bileşikler olmak üzere ikiye ayrılır.
1. iyonik bileşikler (iyonik bağlı bileşikler)
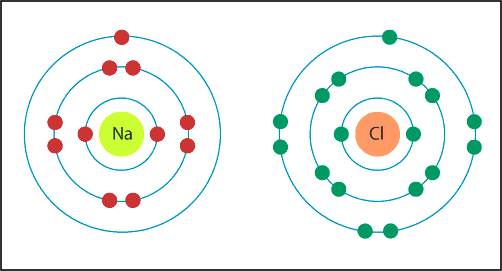
Elektron alış verişi sonucunda meydana gelen zıt elektrik yüklü iyonların elektrostatik çekim kuvveti ile birbirlerini çekmeleri sonucunda oluşan bağa iyonik bağ, bileşiğe ise iyonik bağlı bileşik denir. Daha çok metal-ametal atomları arasında gerçekleşir. Çünkü metal atomları elektron vermeye daha yatkın iken; ametal atomları ise elektron almaya daha isteklidir. Örneğin NaCl, NaBr, KCl, KI, CaO, MgO bu türden bileşiklere örnek olarak verilebilir.
Nötr durumda toplam 11 elektronu bulunan sodyum atomunun (Na) 1. yörüngesinde 2, 2. yörüngesinde 8 ve 3. yörüngesinde 1 elektronu bulunur. Nötr durumda 17 elektronu bulunan klor (Cl) atomunun ise 1. yörüngesinde 2, 2. yörüngesinde 8 ve 3. yörüngesinde 7 elektronu bulunur. Bu iki elementin atomları bir bileşik oluşturmak üzere bir araya geldiklerinde sodyum atomları son yörüngelerinde bulunan ve en kararsız durumdaki bir elektronlarını yitirerek kimyasal olarak daha kararlı olan sodyum iyonlarına (Na+) dönüşürler. Klor atomları ise sodyum atomlarının yitirdiği bu bir elektronu alarak son yörüngelerindeki elektron sayısını sekize çıkararak daha kararlı olan klor iyonlarına (Cl-) dönüşürler. Böylelikle artı elektrik yükü ile yüklü sodyum iyonları (Na+) ile eksi elektrik yükü ile yüklü klor iyonları (Cl-) zıt elektrik yüküne sahip olduklarından elektrostatik çekim kuvveti ile birbirlerini çekerek NaCl (Sodyum Klorür) adlı ve sofralarımızda yemek tuzu olarak tükettiğimiz yeni bir bileşiğin oluşmasını sağlarlar.
iyonik bileşiklerin özellikleri
1. moleküler bileşikler (moleküler bağlı bileşikler)
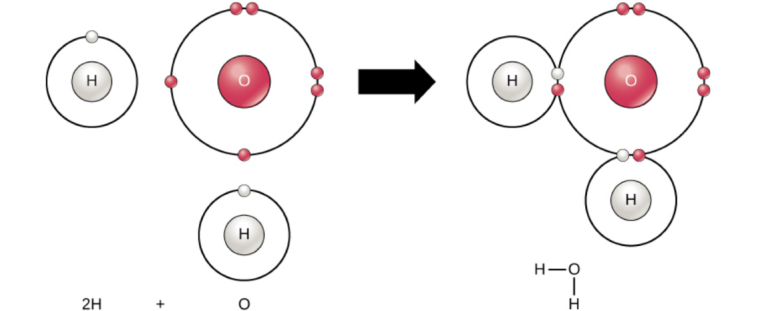
Tanecikleri moleküller şeklinde olan (moleküllerden oluşan) bileşiklere moleküler bileşik, oluşan bağa ise moleküler bağ denir. Moleküler bir bileşik oluşurken iki atom arasında iyonik bir bileşikte olduğu gibi bir elektron alış-verişi söz konusu değildir. Daha çok ametal-ametal atomları arasında görülen bu bileşiklerde elektron çiftleri iki atom arasında ortaklaşa olarak kullanılır. Sonunda kovalent bağ denen bir bağ ile iki atom birbirlerine bağlanarak bir bileşik oluştururlar. Örneğin H2O, CO2, C6H12O6, CH4, C6H6, NO bu türden bileşiklere örnek olarak verilebilir.
Oksijen (O) atomunun son enerji düzeyinde 6, hidrojen (H) atomunun son enerji düzeyinde ise 1 elektron bulunur. Oksijen atomu kararlı bir hale geçebilmek için son enerji düzeyindeki elektron sayısını 8'e, hidojen ise 2'ye tamamlamak ister. Bunun için 2 tane hidrojen ile 1 tane oksijen atomu bir araya gelerek ortaklaşa kullanacakları 2 tane elektron çift oluştururlar. Bu iki elektron çifti oksijen atomunun son enerji düzeyindeki elektron sayısının 8'e ve hidrojen atomunun ise 2'ye çıkmasını sağlayarak bu iki atomun kararlı bir hale geçmesini ve H2O (su) bileşiğinin oluşmasını sağlar.
moleküler bileşiklerin özellikleri
Share Your Expertise, Earn Rewards!
Found this insightful? Imagine your knowledge generating income. Contribute your articles to bylge.com and connect with readers while unlocking your earning potential.