Elektron İlgisi Nedir ?

Pow
Elektron İlgisi Gaz hâlindeki bir atomun elektron kazanması sırasındaki enerji değişiminin bir ölçüsüne elektron ilgisi denir. Elektron ilgisi enerjisi, iyonla
Elektron İlgisi
Gaz hâlindeki bir atomun elektron kazanması sırasındaki enerji değişiminin bir ölçüsüne elektron ilgisi denir. Elektron ilgisi enerjisi, iyonlaşma enerjisinin tersidir. Elektron ilgisi enerjisinin değeri, bir elementin atomlarının elektron almaya ne kadar istekli olup olmadıklarını gösterir. Elektron ilgisi aynı zamanda bir atomun ilave bir elektronu ne kadar güçlü bir şekilde kendisine bağlayıp bağlayamayacağının da bir ölçüsüdür.
Gaz hâlindeki bir mol atomun, bir mol elektron kazanması sırasındaki enerji değişimi ölçülerek elektron ilgisinin değeri hesaplanabilir. Elektron ilgisinin birimi kilojoule/mol (kJ/mol) olup, kısaca Eİ şeklinde gösterilir.
X (g) + eˉ → Xˉ (g) + Enerji
İyonlaşma enerjisi, artı yüklü çekirdek tarafından çekilen bir elektronu koparmak için, dışarıdan enerji (ısı) verilmesini gerekterin bir olay olduğu için endotermiktir. İyonlaşma enerjisinin tersine, atomların birinci elektron ilgisinin enerjisi ekzotermik (ısı veren) veya endotermik (ısı alan) olabilir. Ancak bütün atomların ikinci elektron ilgisinin enerjisi endotermiktir.
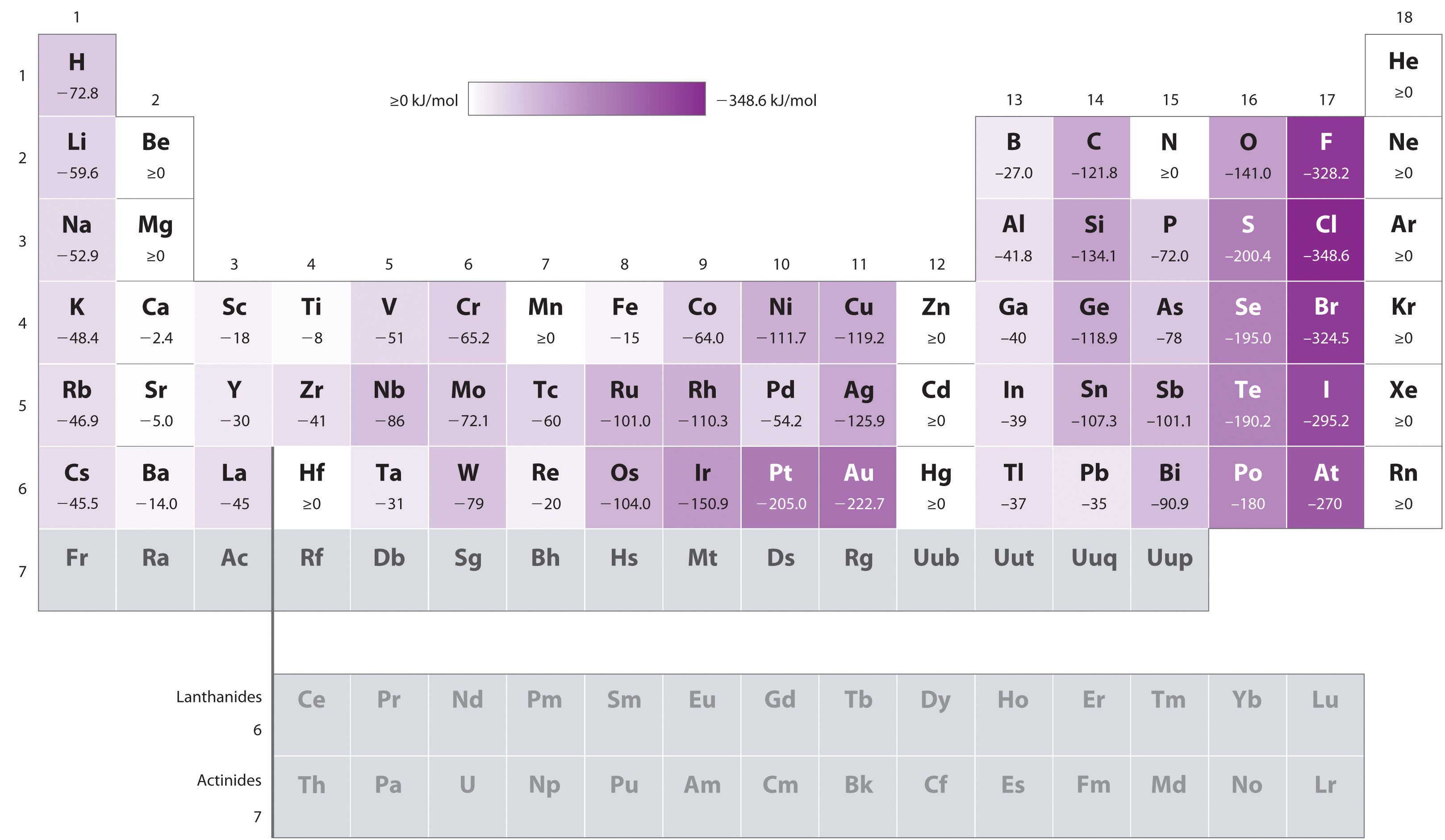
Atomlarının çoğu, elektron kazandıkları sırada enerji açığa çıkar. Bu, ekzotermik (ısı veren) bir olay olduğu için reaksiyonun entalpisi 0'dan (ΔH < 0) küçük olur. Toprak Alkali Metaller (2A Grubu Elementleri) ile Soy Gazlar (8A Grubu Elementleri) kararlı elektronik yapıya (tam dolu simetri kararlı yapı) sahip olduklarından kendiliğinden elektron alamazlar. Bunların elektron alabilmeleri için dışarıdan enerji (ısı) verilmesi gerekir. Bu, endotermik (ısı alan) bir olay olduğu için reaksiyonun entalpisi 0'dan (ΔH > 0) büyük olur. Aşağıda bazı elementlerin birinci elektron ilgisinin değerleri verilmiştir.
Na (g) + eˉ → Naˉ (g) + 52,9 kJ (Eİ₁ = -52,9 kJ/mol)
Ca (g) + eˉ + 186 kJ → Caˉ (g) (Eİ₁ = +186 kJ/mol)
C (g) + eˉ → Cˉ (g) + 122 kJ (Eİ₁ = -122 kJ/mol)
Cl (g) + eˉ → Clˉ (g) + 349 kJ (Eİ₁ = -349 kJ/mol)
Ne (g) + eˉ + 29 kJ → Neˉ (g) (Eİ₁ = +29 kJ/mol)
Artı yüklü bir atomun (+1 yüklü bir katyon iyonunun) birinci elektron ilgisinin enerjisi, nötr durumdaki atomunun birinci iyonlaşma enerjisine eşittir.
X⁺ (g) + eˉ → X (g) + Eİ₁
X (g) + E₁ → X⁺ (g) + eˉ
(Eİ₁ = E₁)
Elektron İlgisi En Büyük Olan Element
Elektron ilgisi en fazla olan element, elektron almaya en yatkın (elektron ilgileri en fazla) grup olan Halojenlerin (7A grubu) içerisindeki Klor (Cl) elementidir. Klor'un 1. elektron ilgisinin enerjisi -349 kJ/mol'dür. Klor'dan sonra elektron ilgisi en yüksek olan element ise yine bir Halojen olan Flor (F)'dur. Flor'un elektron ilgisinin değeri ise -328 kJ/mol'dür. Elektron ilgisinin büyük bir negatif değer olması elektron alma işlemi sırasında büyük bir enerjinin açığa çıktığını ve bu durumdaki bir atomun elektron almaya çok istekli olduğunu gösterir. Eksi işareti değerin azaldığının bir göstergesi değildir. Soygazların (8A Grubu) elektron ilgileri yoktur. 2B (s²d¹⁰), 7B (s²d⁵) ve 8A (s²p⁶) grubu elementlerinin elektron ilgisi değerleri ise pozitiftir.
Negatif bir iyon ile bir elektron aynı elektrik yüküne sahip olacaklarından dolayı birbirlerini iteceklerinden, negatif bir iyona (anyon) bir elektron katılabilmesi için dışarıdan enerji (ısı) verilmesi gerekir. Bu nedenle, bütün elementlerin ikinci elektron ilgisinin değerleri, 0'dan büyük yani, pozitif olur. Aşağıda oksijenin (O) birinci ve ikinci elektron ilgisinin değerleri verilmiştir.
O (g) + eˉ → Oˉ (g) + 142 kJ (Eİ₁ = -142 kJ/mol)
Oˉ (g) + eˉ + 844 kJ → Oˉ² (g) (Eİ₂ = +844 kJ/mol)
Elektron İlgisi Nasıl Artar
Periyodik cetvelde, aynı periyot boyunca soldan sağa doğru gidildikçe elektron ilgisinin değeri artar. Aynı grupta ise aşağıdan yukarı doğru çıkıldıkça elektron ilgisinin değeri genellikle (İstisna olarak klorun elektron ilgisi florunkinden daha büyüktür) artar. Ametallerin elektron ilgileri metallerinkinden daha fazladır. Soy gazların elektron ilgilerinin değeri ise (oldukça kararlı bir yapıya sahip olmalarından dolayı) yok denecek kadar az olup, sıfır veya sıfıra yakın olarak kabul edilir. Dolayısıyla aynı periyotta 7A grubunun elektron ilgisi en fazladır.
Share Your Expertise, Earn Rewards!
Found this insightful? Imagine your knowledge generating income. Contribute your articles to bylge.com and connect with readers while unlocking your earning potential.