İyon Nedir?

Pow
İyon Nedir ? İyon nedir sorusuna geçmeden önce atomu ve yapısını kısaca açıklayalım. Elementlerin tüm fiziksel ve kimyasal özelliklerini taşıyan en küçük yapı t
İyon Nedir ?
İyon nedir sorusuna geçmeden önce atomu ve yapısını kısaca açıklayalım. Elementlerin tüm fiziksel ve kimyasal özelliklerini taşıyan en küçük yapı taşlarına atom denir. Bir atom merkezinde artı yüklü bir çekirdek ile çekirdeğin çevresindeki belirli enerji düzeylerinde dolanan eksi yüklü elektronlardan oluşur. Çekirdek te ise artı yüklü proton ve yüksüz nötron adı verilen tanecikler bulunur. Genellikle bir atom da çekirdeğin taşıdığı artı elektrik yükü elektronların taşıdığı eksi elektrik yüküne eşit olduğu için bu iki yük birbirini dengeler ve böylelikle atom dışarıya karşı elektriksek olarak yüksüz (nötr) bir durumdadır. Ancak bir atom elektronlarından bir veya birkaçını kaybederse veya dışarıdan bir veya birkaç elektron kazanırsa elektrik yükü dengesi bozulacağı için iyon adı verilen bir taneciğe dönüşür. İyonlar artı veya eksi elektrik yüklü atom veya atom gruplarıdır.
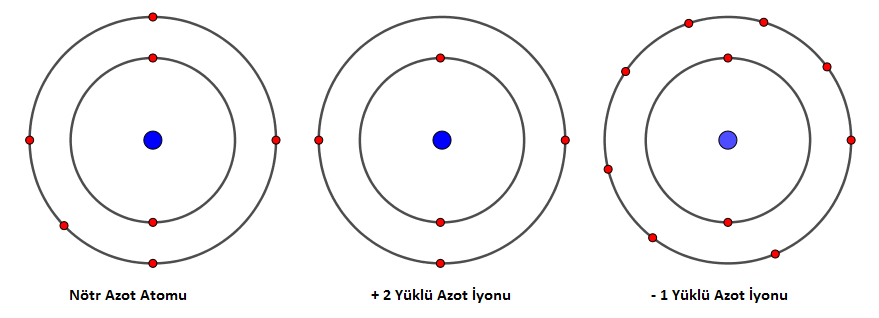
Örneğin, N (Azot) atomunun çekirdeğinde yedi tane + yüklü proton ve yörüngelerinde ise yedi tane – yüklü elektron bulunur. Artı yük sayısı eksi yük sayısını dengelediği için bu durumdaki bir azot atomu dışarıya karşı yüksüz (nötr) bir durumdadır.
Artı Yüklü İyon (Katyon)
Dışarıya bir veya daha fazla sayıda elektron vererek kararlı hale geçen artı yüklü iyonlara Katyon denir.
Atomların en dış yörüngelerindeki elektronlar çekirdeğe en uzak durumda bulunan elektronlardır. Bir atomda çekirdekten uzaklaştıkça elektronlara etki eden çekim gücü giderek zayıflar. Bu yüzden atomların en dış yörüngelerindeki elektronlar en kararsız ve oynak durumdaki elektronlar olup kolayca atomdan ayrılabilir veya koparılabilir.
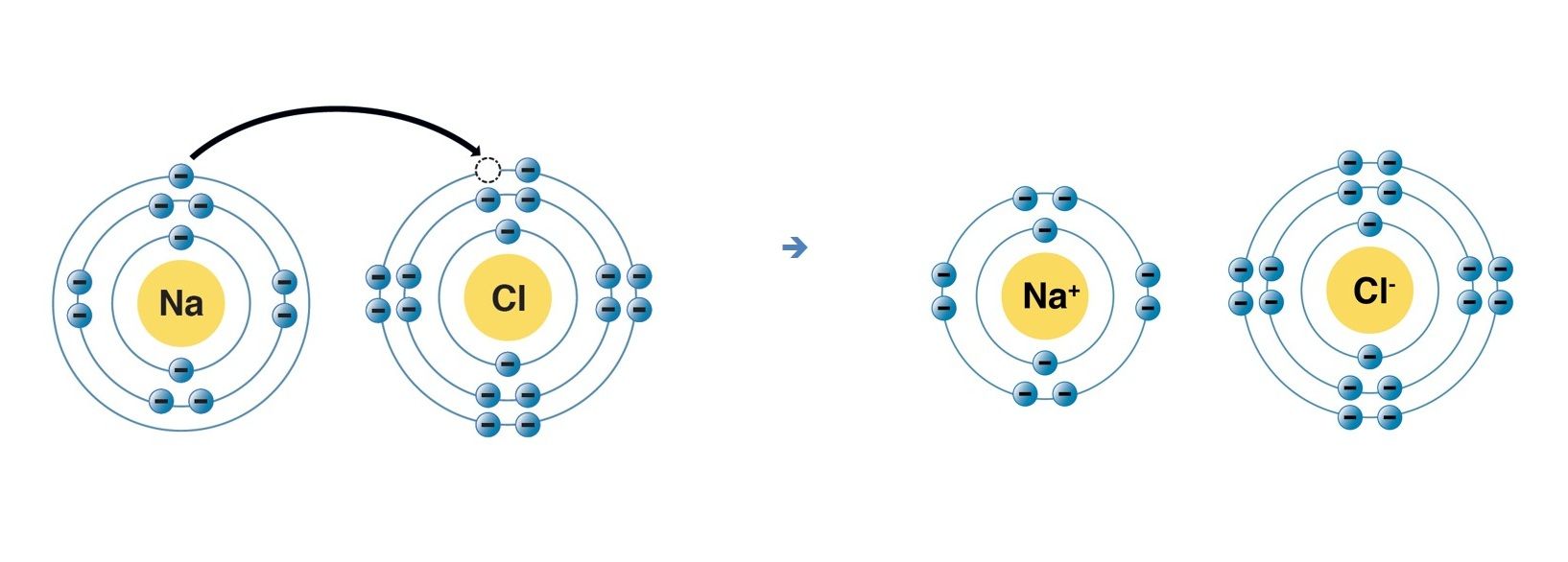
Örneğin, bir Na (Sodyum) atomunun çekirdeğinde 11 tane + yüklü proton ve yörüngelerinde ise 11 tane – yüklü elektron vardır. Na atomunun çekirdeğe en yakın yörüngesinden başlamak üzere 1. enerji düzeyinde 2, 2. enerji düzeyinde 8 ve 3. enerji düzeyinde 1 elektronu (2 – 8 – 1)vardır. Bu durumdaki bir Na atomu oldukça kararsızdır ve son yörüngesindeki elektron sayısını ya dışarı bir elektronun vererek (2 – 8) ya da dışarıdan yedi elektron alarak (2 – 8 – 8) şekline dönüştürerek kararlı bir hale geçmek ister. Bir elektron vermek yedi elektron kazanmaktan daha kolay olduğu için Na atomu dışarıya bir elektron vererek iyon adını verdiğimiz artı elektrik yüklü kararlı bir taneciğe dönüşür. Na atomu dışarıya bir elektron verdiği zaman atomdaki artı – eksi yük dengesi bozulur. Artı yük sayısı eksi yük sayısından fazla olan artı yüklü böyle iyonlara Katyon denir.
Eksi Yüklü İyon (Anyon)
Dışarıdan bir veya daha fazla sayıda elektron alarak kararlı hale geçen eksi yüklü iyonlara anyon denir.
Örneğin, bir Cl (Klor) atomunun çekirdeğinde 17 tane + yüklü proton ve yörüngelerinde ise 17 tane – yüklü elektron vardır. Cl atomunun çekirdeğe en yakın yörüngesinden başlamak üzere 1. enerji düzeyinde 2, 2. enerji düzeyinde 8 ve 3. enerji düzeyinde 7 elektronu (2 – 8 – 7) bulunur. Bu durumdaki bir Cl atomu oldukça kararsızdır ve son yörüngesindeki elektron sayısını ya dışarı yedi elektronun vererek (2 – 8) ya da dışarıdan bir elektron alarak (2 – 8 – 8) şekline dönüştürerek kararlı bir hale geçmek ister. Yedi elektron vermek bir elektron kazanmaktan daha zor olduğu için Cl atomu dışarıdan bir elektron alarak iyon adını verdiğimiz eksi elektrik yüklü kararlı bir taneciğe dönüşür. Cl atomu dışarıdan bir elektron kazandığı zaman artı – eksi yük dengesi bozulur. Eksi yük sayısı artı yük sayısından fazla olan eksi yüklü böyle iyonlara Anyon denir.
İyonik Bağlı Bileşikler
Bazı bileşikler iki atomun bir araya gelerek elektron alış-verişi yapmaları sonucunda oluşur. Örneğin, kararsız durumdaki Na atomu ile Cl atomu bir araya geldiklerinde elektronlarının diziliş düzeni 2 – 8 – 1 şeklinde olan Na atomu, elektronlarının diziliş düzeni 2 – 8 – 7 şeklinde olan Cl atomuna bir elektron vererek kararlı artı yüklü sodyum iyonuna dönüşürken Cl atomu ise kararlı eksi yüklü klor iyonuna dönüşür. Fizik kanunlarına göre zıt elektrik yükü ile yüklü tanecikler birbirini çekeceği için + yüklü Na atomu ile – yüklü Cl atomu birbirlerini çekerek iyonik bağlı bir bileşik olan NaCl’ü (Yemek Tuzu) oluştururlar.
İyonik Bağlı Bileşikler Suda İyonlarına Ayrışarak Çözünürler
İyonik bileşiklerin sulu çözeltileri elektrik akımını iletirler. Çünkü çözeltide bulunan su molekülleri her bir iyonun etrafını sararak onu diğerlerinden ayırır. İyonlarına ayrışmış durumdaki çözeltiden bir elektrik akımı geçirilirse artı yüklü katyonlar elektrotun Anot kutbuna doğru yönelirken eksi yüklü anyonlar ise elektrotun katot kutbuna doğru yönelir ve sonuçta yüklü taneciklerin bu hareketi bir elektrik akımı oluşmasını sağlar.
Share Your Expertise, Earn Rewards!
Found this insightful? Imagine your knowledge generating income. Contribute your articles to bylge.com and connect with readers while unlocking your earning potential.