İyonik Bağ Nedir ?

Pow
İyonik Bağ Atomları bir arada tutan veya atomların bir arada durmasını sağlayan etkileşimlere kimyasal bağ denir. İki çeşit kimyasal bağ vardır. Kovalent bağ o
İyonik Bağ
Atomları bir arada tutan veya atomların bir arada durmasını sağlayan etkileşimlere kimyasal bağ denir. İki çeşit kimyasal bağ vardır. Kovalent bağ olarak da bilinen kimyasal bağ türünde, aynı veya farklı türdeki iki atom, ortaklaşa paylaştıkları ve her ikisinin de çevresinde dönen elektron çiftlerince bir arada tutulur. Atomlar arasında meydana gelen bir başka kimyasal bağ türü de, iyonik bağdır. Bu bağ türünde, bir atomdan diğerine elektron transferi gerçekleşir ve sonuçta artı ve eksi elektrik yüklü iyonlar oluşur. Oluşan bu karşıt yüklü iyonların birbirlerine karşı uygulamış oldukları elektrostatik çekim kuvveti onların bir arada durmasını sağlar.
İyonik Bağ Nasıl Oluşur ?
Bir atomun bir başka atomla birleşebilme yeteneğine o atomun değerliği denir. Değerlik, bir atomun kararlı bir yapıya sahip olabilmesi için kazandığı veya yitirdiği elektron sayısıdır. Atomların kararlı bir yapıya sahip olabilmesi için, en dıştaki enerji düzeylerinde toplam sekiz adet elektronun bulunması zorunludur. (en hafif atomlar olan hidrojen ve helyum da bu sayı ikidir)
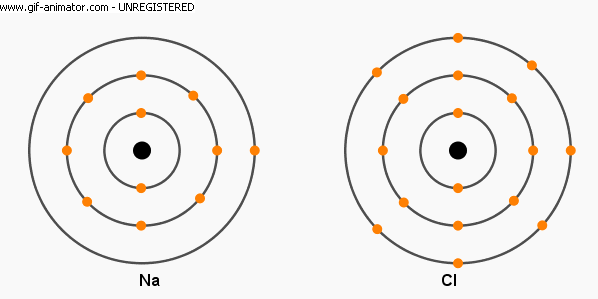
Örneğin, elektron sayısı 11 olan sodyum atomunun (Na) en dıştaki enerji düzeyinde 1, bir önceki enerji düzeyinde ise 8 adet elektron bulunur. Öte yandan elektron sayı 17 olan klor atomunun (Cl) ise en dıştaki enerji düzeyinde 7 adet elektron vardır. Sodyum ve klor atomları bir araya geldiğinde, sodyum atomları en dıştaki enerji düzeylerinde bulunan bir elektronlarını yitirerek (klor atomlarına vererek) artı elektrik yüklü ve kimyasal olarak nötr sodyum atomlarından daha kararlı sodyum iyonlarına (Na⁺) dönüşürler. Klor atomları ise, bir elektron kazanarak (sodyum atomlarından alarak) son enerji düzeylerindeki elektron sayısını sekize çıkarıp kimyasal olarak nötr klor atomlarından daha kararlı klor iyonlarına (Clˉ) dönüşürler. Elektrik konusundan bildiğimiz üzere, zıt elektrik yükü ile yüklü tanecikler birbirlerini çekeceğinden, sonuçta artı elektrik yüklü sodyum iyonları ile eksi elektrik yüklü klor iyonları birbirini çekip birleşerek yemek veya sofra tuzu olarak da bildiğimiz sodyum klorür (NaCl) adlı bileşiği oluştururlar. Olayın denklemi aşağıdaki şekildeki gibi gösterilebilir.
Na⁺ + Clˉ → NaCl
İyonik Bağ Örnekleri
1. Sodyum Klorür (NaCl)
2. Magnezyum Klorür (MgCl₂)
3. AlBr₃ (Alüminyum Bromür)
4. Ag₂O (Gümüş Oksit)
5. LiF (Lityum Florür)
6. CaS (Kalsiyum Sülfür)
7. CaI₂ (Kalsiyum İyodür)
8. Fe₂O₃ (Demir III Oksit)
9. KCl (Potasyum Klorür)
10. FeS (Demir Sülfür)
İyonik Bağlı Bileşiklerin Özellikleri
Share Your Expertise, Earn Rewards!
Found this insightful? Imagine your knowledge generating income. Contribute your articles to bylge.com and connect with readers while unlocking your earning potential.