Kovalent Bağ Nedir?

Pow
Kovalent Bağ İki atom arasında elektron çifti ortaklaşmasına dayanarak kurulan kimyasal bir bağ türüdür. İyonik bağdan farklı olarak bu bağ türünde, iki atom a
Kovalent Bağ
İki atom arasında elektron çifti ortaklaşmasına dayanarak kurulan kimyasal bir bağ türüdür. İyonik bağdan farklı olarak bu bağ türünde, iki atom arasında herhangi bir elektron alış-verişi söz konusu değildir. Polar ve apolar kovalent bağ olmak üzere ikiye ayrılır.
Kovalent Bağ Nasıl Oluşur?
Kovalent bağlı bileşiklerde, ortaklaşa kullanılan - (negatif) elektrik yüklü elektron çiftleri her iki atomun çekirdeğinin çevresinde dönerek + (artı) elektrik yüklü çekirdeği kendilerine doğru çeker. Çekirdek ile elektron çiftleri arasında oluşan bu güçlü elektriksel çekim kuvveti atomların bir arada durmasını ve aralarında kimyasal bir bağın oluşmasını sağlar. Çünkü atomlar kararlı bir yapıya sahip olabilmek için son enerji düzeylerindeki (yörünge) elektron sayılarını sekize (hidojen ve helyum için ikidir) tamamlamak isterler.
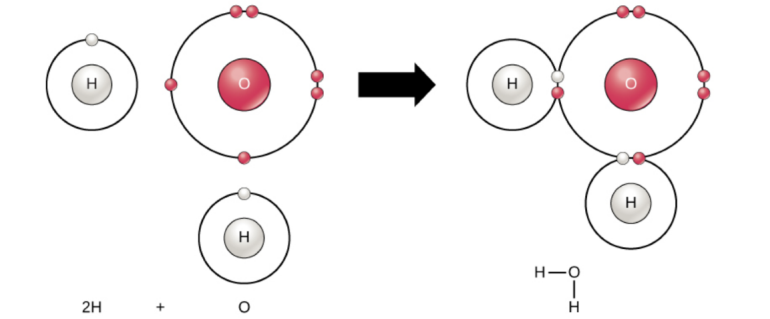
Yukarıda resimde H2O (su) molekülünün oluşumu gösterilmektedir. Oksijen (O) atomunun son enerji düzeyinde 6, hidrojen atomunun son enerji düzeyinde ise 1 elektron bulunmaktadır. Oksijen atomu kararlı bir hale geçebilmek için son yörüngesindeki elektron sayısını 8'e, hidojen ise 2'ye tamamlamak ister. Bunun için 2 tane hidrojen ile 1 tane oksijen atomu bir araya gelerek ortaklaşa kullanacakları 2 tane elektron çift oluştururlar. Bu iki elektron çifti oksijen atomunun son yörüngesindeki elektron sayısının 8'e ve hidrojen atomunun ise 2'ye çıkmasını sağlayarak bu iki atomun kararlı bir hale geçmesini sağlar.
Kovalent Bağ Çeşitleri
Polar ve apolar kovalent bağ olarak ikiye ayrılır. Polar kovalent bağda bağı oluşturan atomlar birbirinden farklıdır. Örneğin H2O (su) bileşiğini oluşturan bağ, polar kovalent bir bağdır. Aynı iki ametal atomu arasında oluşan kovalent bağa ise apolar kovalent bağ denir. Örneğin H2 (hidrojen gazı) ve O2 (oksijen gazı) bileşiklerini oluşturan bağ, apolar kovalent bir bağdır.
Kovalent Bağlı Bileşikler (Kovalent Bağ Örnekleri)
Kovalent bağ, genellikle benzer elektronegatifliğe (bağ yapımında kullanılan elektronların bağı oluşturan atomlar tarafından çekilme gücü) sahip atomlar arasında daha çok görülür. Bu nedenle ametal-ametal atomları arasında oluşan bileşikler genellikle kovalent bağlı bileşiklerdir. Çünkü bir Ametal atomundan bir elektron koparmak veya serbest kalmasını sağlamak metal atomuna göre daha zordur ve daha çok enerji gerektirir.
Örnegin H2O (su), NH3 (amonyak), CH4 (metan), HCl (hidroklorük asit), CO2 (karbondioksit), SO2 (kükürt dioksit), H2 (hidrojen) ve O2 (oksijen) birer kovalent bağlı bileşiktir.
Kovalent Bağ Özellikleri
Share Your Expertise, Earn Rewards!
Found this insightful? Imagine your knowledge generating income. Contribute your articles to bylge.com and connect with readers while unlocking your earning potential.